文/中央社
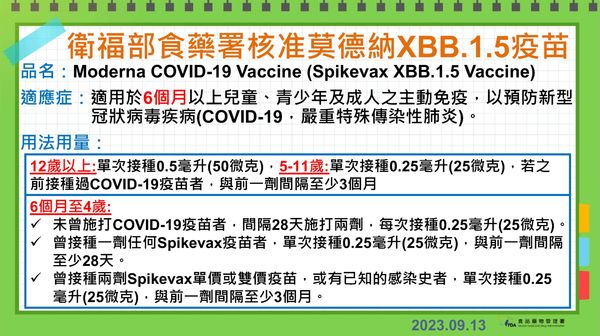
衛福部食藥署今天公布,通過莫德納XBB.1.5疫苗EUA,適用於6個月以上兒童、青少年及成人,因已收到測試標準品,疫苗到貨後最快7天可完成檢驗封緘,9月底前有望開打。
食藥署核准莫德納XBB.1.5 疫苗專案輸入。(圖/食藥署提供)
台灣在今年5月1日將COVID-19(2019冠狀病毒疾病),由第5類法定傳染病改為第4類、指揮中心同步解編,但疫情仍持續。根據衛福部疾病管制署統計,近4週監測總計,本土檢出病毒株XBB為主流株、占99%。
衛福部食品藥物管理署今天召開專家會議,審查莫德納公司COVID-19最新一代XBB.1.5疫苗緊急使用授權(EUA)。食藥署副署長陳惠芳傍晚接受媒體電訪表示,會中通過核准莫德納XBB.1.5疫苗專案輸入,適用於6個月以上兒童、青少年及成人的主動免疫接種。
目前食藥署已收到檢測品,包括標準品跟疫苗樣品都有,根據過去經驗,疫苗到貨後最快7天可完成檢驗封緘作業,陳惠芳說,正預作相關事宜,一定會全力配合疾管署的疫苗接種政策規劃。
疾管署發言人曾淑慧晚間接受媒體聯訪說明,首批預估將有200萬劑;先前預估最快9月最後一週開打,不過疫苗進口後還需要檢驗封緘等流程,才能給醫療院所施打,下週二會再進一步說明接種規劃。
食藥署表示,經審查,XBB.1.5疫苗與先前已核准的莫德納疫苗採用相同的技術平台製造,具有相似的特性,可對目前流行的變異病毒株提供保護效益優勢;在安全性方面,不良反應與先前已核准的莫德納疫苗相似,以輕中度不良反應為主。
繼美國食品暨藥物管理局(FDA)於當地11日核准輝瑞BNT、莫德納的最新一代COVID-19疫苗,作為加強針供入秋後全面施打。兩支新版回復為單價疫苗,能應對今年稍早Omicron的XBB.1.5變異株,台灣是第4個通過國家。